Mol Cell:程红研究组合作揭示细胞核中RNA命运决定的基本规律
来源:生物探索 2024-10-31 13:40
本研究揭示了新生RNA的命运最初被预设为降解,但伴随转录和加工过程的推进,其命运可被重塑,RNA的特征决定了其最终被分选为出核或降解通路。
遗传信息的传递和表达是一切生命活动的物质基础。在真核生物中,RNA聚合酶II转录产生多种类型的RNA,尽管这些RNA在基本结构上高度相似,它们的命运却截然不同:有些RNA被顺利转运出核,而另一些则在细胞核中迅速被识别并降解。RNA能够正确地被分选到出核或降解通路,是确保遗传信息精确表达的关键环节。研究表明,出核与降解机器通过竞争结合新生RNA来完成RNA分选。目前,领域内普遍认为出核通路在RNA分选中占主导地位,只有那些未能与出核机器结合的RNA,才会被降解机器结合并清除。然而,这种出核主导的RNA分选机制可能无法有效保证异常RNA的快速清除,从而对细胞功能产生潜在影响。
中国科学院分子细胞科学卓越创新中心程红课题组与武汉大学周宇教授合作,在Molecular Cell期刊在线发表了题为 Dual modes of ZFC3H1 confers selectivity in nuclear RNA sorting 的研究论文,提出并证明了“降解-预设”的RNA 分选新模型,改变了现有的“出核-预设”的RNA分选观点。

外切体是细胞中最主要的RNA降解机器之一,几乎参与了每个RNA分子的命运调控。外切体功能的发挥依赖于接头因子,帮助其选择性降解不同类型的底物RNA。PAXT复合体(PolyA eXosome Targeting connection)是外切体的一个重要接头因子,由MTR4和锌指蛋白ZFC3H1组成核心二聚体,并动态结合polyA结合蛋白PABPN1、锌指蛋白ZC3H3和RNA结合蛋白RBM26/27等。早期研究提出, PAXT主要结合在具有3′ polyA尾的成熟RNA上,通过MTR4招募外切体来降解这些底物。由于PAXT底物RNA与功能mRNA结构完全相同,其介导的RNA分选过程尤为具有挑战性。
在本研究中,意外发现ZFC3H1在转录早期便结合在pre-RNA(RNA前体)的5′端外显子和内含子上。有趣的是, ZFC3H1在此阶段处于自我封闭的模式,阻断了MTR4与外切体的结合,因此并不启动RNA降解。这种“占位”机制可以有效地防止出核因子过早结合而引起的RNA出核紊乱。通过多组学分析,该研究全面解析了PAXT降解底物RNA的特征,包括较少的外显子,较短的长度和较长的polyA尾等。这些特征如何促使ZFC3H1从“占位”模式转换为“降解”模式呢?当RNA包含多个内含子时,剪接过程中出核因子会被招募,并向5′端传递,取代ZFC3H1;而对于少外显子的短RNA,其较长的polyA尾可有助于招募更多PAXT组分(如ZC3H3和RBM26/27),解除ZFC3H1的封闭状态,暴露MTR4,从而启动降解。
综上所述,本研究揭示了新生RNA的命运最初被预设为降解,但伴随转录和加工过程的推进,其命运可被重塑,RNA的特征决定了其最终被分选为出核或降解通路。基于这一发现,研究人员提出了以降解为中心的RNA分选机制,既确保了异常RNA的快速降解,又保证了功能性RNA的高效出核。这一工作揭示了细胞核RNA分选的基本规律,深化了对遗传信息精准传递的理解。
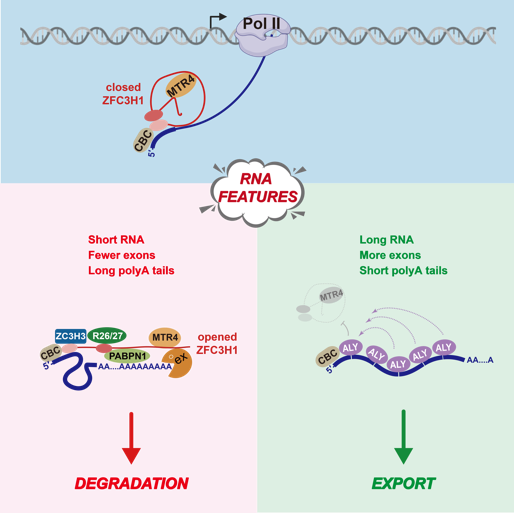
模式图(Credit: Molecular Cell)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


